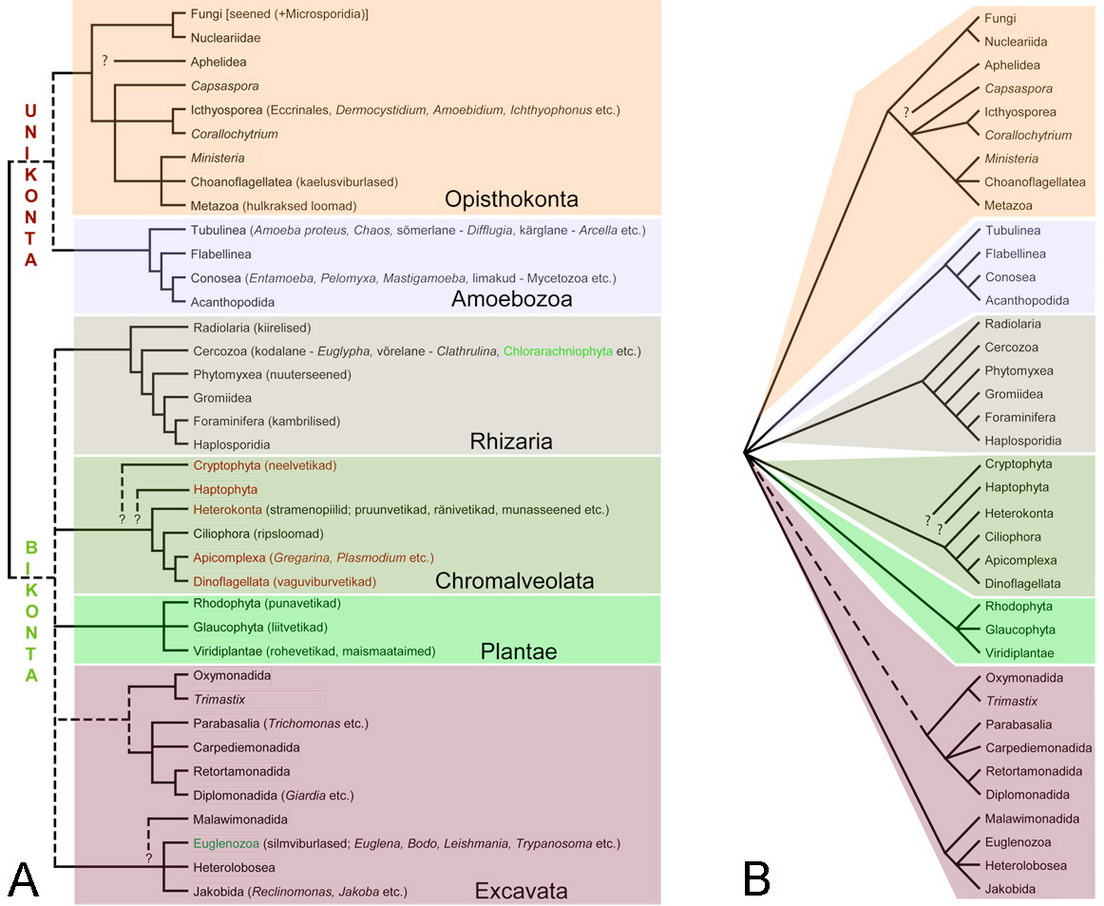

Joonis 2. Eukarüootide fülogenees. (A) Eukarüootide puu ainu- ja kaheviburilisteks (Bikonta & Unikonta) jagamine Stechmann & Cavalier-Smith (2003) järgi (täpsemalt allpoolt toodud kommentaarides). Tagaviburlaste (Opisthokonta) fülogenees Cafaro (2005), Ruiz-Trillo et al. (2004) ja Steenkamp et al. (2006) järgi; Aphelidea tõenäoliselt kuulub Opisthokonta klaadi (Adl et al., 2005), kuid geenijärjestuste andmed sellest rühmast veel puuduvad. Amoebozoa fülogenees Smirnov et al. (2005) järgi. Rhizaria fülogenees Nikolaev et al. (2004) ja Molecular Systematics Group (MSG) järgi. Chromalveolata kohta vaata näiteks Harper et al. (2005). Plantae kohta vaata Rodríguez-Ezpeleta et al. (2005). Excavata fülogenees Cavalier-Smith (2003), Hampl et al. (2005) ja Simpson et al. (2006) järgi. Roheliselt on märgitud taksonite nimed, kes on oma sekundaarsed plastiidid saanud rohevetikatelt; punaselt aga taksonid, kes on plastiidid saanud punavetikatelt (täpsemalt allpool toodud kommentaarides). (B) Konservatiivsem variant eukarüootide fülogeneesist, kus pole toodud Unikonta ja Bikonta klaadi. Vaata uuemat versiooni siit (inglise keeles).
Praeguse seisuga põhineb eukarüootide kaheks jagamine (primitiivselt ainu- ja kaheviburilised) peamiselt sellel, millised geenid kummalgi rühmal on kokku liitunud üheks funktsionaalseks üksuseks. Kaheviburilistel (bikonts) on dihüdrofolaat reduktaasi (DHFR) ja tümidülaat süntaasi (TS) geenid kokku liitunud; üheviburilistel on aga kolmest pürimidiini sünteesi raja geenist (karbamoüül fosfaat süntaas, dihüdroorataas ja aspartaadi karbamoüültransferaas) moodustunud liitgeen (Stechmann & Cavalier-Smith, 2002; 2003). Simpson & Roger (2002) tõid välja mõned võimalused, miks ei saa sellistele tunnustele 100% kindel olla. On võimalik, et sellised liitgeenid on omandatud eukarüootide evolutsiooni jooksul mitmel sõltumatul korral: kas siis geenide kokkuliitumisi on olnud mitmel erineval juhul või on need omandatud horisontaalsete geeniülekannete tulemusel. Mõlemad eukarüoodi tüüpi DHFR ja TS geenid on olemas ka mõnedel viirustel (Simpson & Roger, 2002). Seoses kolme pürimidiini sünteesi raja geeniga on probleem aga selles, et need kolm geeni paistavad olevat kokku liitunud ka punavetikal Cyanidioschyzon merolae, kes on kaheviburiline (Arisue et al., 2005). Unikonta klaadi toetavad veel osad multigeensed analüüsid (Baldauf & Doolittle, 1997; Baldauf et al., 2000; Bapteste et al., 2002), kuid teised jälle mitte (Nozaki et al., 2003; Arisue et al., 2005).
Thomas Cavalier-Smith, kes on eukarüootide süstemaatika üks põhitegijaid, on rühmad Cryptophyta, Haptophyta ja Heterokonta oma Chromista riiki liitnud (vt. Cavalier-Smith, 1998). Chromista on ta omakorda liitnud alveolaatidega (Alveolata) rühma chromalveolata (Cavalier-Smith, 1999). Kõikidel autotroofsetel Chromalveolata esindajatel on plastiidid (tippeosprotistide plastiidid on fotosünteesi võime kaotanud), mis pärinevad punavetikatest (mõnede vaguviburvetikate plastiidid on siiski pärit rohevetikatest). Cavalier-Smith (1999) pakkus, et punavetika omastamine on eukarüootide evolutsioonis toimunud ainult ühel korral (chromalveolata hüpotees), mida toetavad plastiidide ja plastiididega seotud rakutuuma geenijärjestuste analüüsid (e. g. Yoon et al., 2002; Harper & Keeling, 2003). Plastiididega mitteseotud tuumageenide analüüsid ei ole selget vastust andnud (Harper et al., 2005). Chromalveolata hüpotees nõuab aga plastiidide sekundaarset kadumist mitmetes rühmades (neid pole leitud näiteks ripsloomadel ja mitmete stramenopiilide rühmadel) ja seetõttu pooldavad näiteks Falkowski et al. (2004) ideed, kus punavetikatega seotud sekundaarne endosümbioos (endosümbioosidest on pisut kirjutatud allpool) on ette tulnud sõltumatult mitmel korral (vt. ka Grzebyk et al., 2004).
Kui joonisel 8A toodud eukarüootide dihhotoomia osutub korrektseks, siis oleks teatud mööndustega võimalik nähtavamat osa elusloodusest (jätame prokarüoodid välja) taas kaheks jaotada (taimed ja loomad), nagu seda on kaua aega tehtud. Kaheviburiliste klaadi kuuluvad maismaataimed ja kõik vetikad (vt. ülal toodud joonist). Erinevus traditsioonilisest taimeriigist oleks see, et välja on jäetud seened ja bakterid ning sisse on arvatud mõned heterotroofsed rühmad. Üheviburiliste klaadi kuuluvad loomad ja osad ainuraksed, keda ka traditsiooniliselt loomariiki arvati. Suurim erinevus traditsioonilisest loomariigist oleks see, et sisse on arvatud ka seened. Cavalier-Smith on elusloodust aastast 1983 jaganud kuueks riigiks (Cavalier-Smith, 1998): Bacteria (bakterid), Protozoa (enam-vähem sama koostisega, mis traditsioonilise loomariigi alamriik ainuraksed), Fungi (seened), Animalia (loomad), Plantae (taimed) ja Chromista. Esimesed kaks riiki on parafüleetilised. Bakterid on parafüleetilised eukarüootide suhtes ja ainuraksete (Protozoa) riigist on välja jäetud loomad, seened, taimed ja Chromista riigi esindajad. Kui seada tingimuseks, et kõik taksonid oleks monofüleetilised, siis tuleks näiteks Protozoa riik mitmeks riigiks jaotada. Kui eesmärgiks on riikide arv madalal hoida, siis tuleks osad riigid ühendada ja need ainuraksed, keda arvatakse Protozoa riiki, ühendada nende lähisugulastega teistest eukarüootide riikidest (näiteks arvata kaelusviburlased loomariiki).
Eukarüootide evolutsioonis on olulist rolli mänginud endosümbioos. Kahte tüüpi organellid - plastiidid (kloroplastid) ja mitokondrid - pärinevad kahtlemata kunagi eukarüoodi poolt fagotsütoosi teel omandatud bakteritest. Mingil põhjusel ei seeditud neid baktereid ära ning peremehe (eukarüoot) ja sümbiondi (bakter) vahel tekkisid mutualistlikud suhted. Selliseid endosümbioose, kus sümbiondist on saanud organell, on kogu eukarüootide evolutsiooni jooksul ette tulnud väga vähe. Mitokonder1 on omastatud ainult ühel korral ning algselt ilma mitokondrita eukarüoote pole suure tõenäosusega olemas. Kõikidel amitokondriaalsetel eukarüootidel, keda on piisavalt lähedalt uuritud, on leitud redutseerunud mitokondrid (hüdrogenosoomid ja mitosoomid) (van der Giezen, M. & Tovar, 2005). Kloroplastide evolutsioon on pisut keerulisem. Primaarne endosümbioos (eukarüoot neelab tsüanobakteri, kellest kujuneb sümbiont) leidis aset taimede (Plantae, vt. ülemist joonist) ühisel eellasel. Sekundaarse endosümbioosi (eukarüoot neelab juba kloroplastiga varustatud eukarüoodi) juhtumeid on mitu. Chromalveolata esindajad omandasid fotosünteesivõime punavetika (Rhodophyta) neelamisel (ühel või mitmel korral). Ülejäänud sekundaarse endosümbioosi juhtumid on aset leidnud Chlorarachniophyta (Rhizaria) ja Euglenida (Excavata: Euglenozoa) esindajate seas, kes omandasid plastiidi rohevetika (Viridiplantae) neelamisel. Vaguviburvetikate (Dinoflagellata) seas on ette tulnud ka tertsiaarset endosümbioosi2.
Hiljuti avaldati üks huvitav artikkel (Marin et al., 2005; vt. ka Rodríguez-Ezpeleta & Philippe, 2006), kus leiti, et toimumas on teistkordne primaarne endosümbioos: protisti Paulinella chromatophora (kuulub Rhizaria klaadi) fotosünteetilised "organellid" paistavad olevat jõudnud evolutsioonilisse staadiumi, mis jääb endosümbiontse tsüanobakteri ja primaarse plastiidi vahele; ning geenijärjestuste järgi pärinevad need võrreldes teiste eukarüootide primaarsete plastiididega erinevast tsüanobakteri harust.
1 - mitokonder pärineb α-proteobakterist (e. g. Gray et al., 1999). Siiski, ühe vähe levinud vaate järgi on mitokondrid polüfüleetilist päritolu ja nende eellasteks protobiondid, kes lahknesid enne tänapäevaste pro- ja eukarüootide ühist eellast (Mikelsaar, 1987).
2 - tertsiaarne endosümbioos tähendab sekundaarse plastiidiga eukarüoodi omastamist.
Viited
Adl, S. M., Simpson, A. G. B., Farmer, M. A., Andersen, R. A., Anderson, O. R., Barta, J. R., Bowser, S. S., Brugerolle, G., Fensome, R. A., Fredericq, S., James, T. Y., Karpov, S., Kugrens, P., Krug, J., Lane, C. E., Lewis, L. A., Lodge, J., Lynn, D. H., Mann, D. G., Mccourt, R. M., Mendoza, L., Moestrup, ¨., Mozley-Standridge, S. E., Nerad, T. A., Shearer, C. A., Smirnov, A. V., Spiegelz, F. W. & Taylor, M. F. J. R. 2005. The New Higher Level Classification of Eukaryotes with Emphasis on the Taxonomy of Protists. Journal of Eukaryotic Microbiology 52: 399–451. [pdf]
Arisue, N., Hasegawa, M. & Hashimoto, T. 2005. Root of the Eukaryota Tree as Inferred from Combined Maximum Likelihood Analyses of Multiple Molecular Sequence Data. Molecular Biology and Evolution 22: 409-420. [pdf]
Baldauf, S. L. & Doolittle, W. F. 1997. Origin and evolution of the slime molds (Mycetozoa). Proceedings of the National Academy of Sciences. USA 94: 12007–12012. [pdf]
Baldauf, S. L., Roger, A. J., Wenk-Siefert, I., Doolittle, W. F. 2000. A Kingdom-Level Phylogeny of Eukaryotes Based on Combined Protein Data. Science 290: 972-977.
Bapteste, E., Brinkmann, H., Lee, J. A., Moore, D. V., Sensen, C. W., Gordon, P., Duruflé, L., Gaasterland, T., Lopez, P., Müller, M. & Philippe, H. 2002. The analysis of 100 genes supports the grouping of three highly divergent amoebae: Dictyostelium, Entamoeba, and Mastigamoeba. Proceedings of the National Academy of Sciences. USA 99: 1414–1419. [pdf]
Cafaro, M. J. 2005. Eccrinales (Trichomycetes) are not fungi, but a clade of protists at the early divergence of animals and fungi. Molecular Phylogenetics and Evolution 35: 21–34.
Cavalier-Smith, T. 1998. A Revised Six-Kingdom System of Life. Biological Reviews 73: 203–266.
Cavalier-Smith, T. 1999. Principles of protein and lipid targeting in secondary symbiogenesis: Euglenoid, dinoflagellate, and sporozoan plastid origins and the eukaryote family tree. Journal of Eukaryotic Microbiology 46: 347–366.
Cavalier-Smith, T. 2003. The excavate protozoan phyla Metamonada Grassé emend. (Anaeromonadea, Parabasalia, Carpediemonas, Eopharyngia) and Loukozoa emend. (Jakobea, Malawimonas): their evolutionary affinities and new higher taxa. International Journal of Systematic and Evolutionary Microbiology 53: 1741–1758. [pdf]
Falkowski, P. G., Katz, M. E., Knoll, A. H., Quigg, A., Raven, J. A., Schofield, O. & Taylor, F. J. R. 2004. The Evolution of Modern Eukaryotic Phytoplankton. Science 305: 354–360.
Hampl, V., Horner, D. S., Dyal, P., Kulda, J., Flegr, J., Foster, P. G. & Embley, T. M. 2005. Inference of the Phylogenetic Position of Oxymonads Based on Nine Genes: Support for Metamonada and Excavata. Molecular Biology and Evolution 22: 2508–2518. [pdf]
Harper, J. T. & Keeling, P. J. 2003. Nucleus-Encoded, Plastid-Targeted Glyceraldehyde-3-Phosphate Dehydrogenase (GAPDH) Indicates a Single Origin for Chromalveolate Plastids. Molecular Biology and Evolution 20: 1730–1735. [pdf]
Harper, J. T., Waanders, E. & Keeling, P. J. 2005. On the monophyly of chromalveolates using a six-protein phylogeny of eukaryotes. International Journal of Systematic and Evolutionary Microbiology 55: 487–496. [pdf]
Gray, M. W., Burger, G. & Lang, B. F. 1999. Mitochondrial Evolution. Science 283: 1476–1481.
Grzebyk, D., Katz, M. E., Knoll, A. H., Quigg, A., Raven, J. A., Schofield, O., Taylor, F. J. R. & Falkowski, P. G. 2004. Response to Comment on "The Evolution of Modern Eukaryotic Phytoplankton". Science 306: 2191.
Marin, B., Nowack, E. C. M. & Melkonian, M. 2005. A Plastid in the Making: Evidence for a Second Primary Endosymbiosis. Protist 156: 425–432.
Mikelsaar, R. 1987. A view of early cellular evolution. Journal of Molecular Evolution 25: 168–183.
Nikolaev, S. I., Berney, C., Fahrni, J. F., Bolivar, I., Polet, S., Mylnikov, A. P., Aleshin, V. V., Petrov, N. B. & Pawlowski, J. 2004. The twilight of Heliozoa and rise of Rhizaria, an emerging supergroup of amoeboid eukaryotes. Proceedings of the National Academy of Sciences. USA 101: 8066–8071. [pdf]
Nozaki, H., Matsuzaki, M., Takahara, M., Misumi, O., Kuroiwa, H., Hasegawa, M., Shin-i, T., Kohara, Y., Ogasawara, N. & Kuroiwa, T. 2003. The Phylogenetic Position of Red Algae Revealed by Multiple Nuclear Genes from Mitochondria-Containing Eukaryotes and an Alternative Hypothesis on the Origin of Plastids. Journal of Molecular Evolution 56: 485–497.
Rodríguez-Ezpeleta, N., Brinkmann, H., Burey, S. C., Roure, B, Burger, G., Löffelhardt, W., Bohnert, H. J., Philippe, H. & Lang, B. F. 2005. Monophyly of Primary Photosynthetic Eukaryotes: Green Plants, Red Algae, and Glaucophytes. Current Biology 15: 1325–1330.
Rodríguez-Ezpeleta, N. & Philippe, H. 2006. Plastid Origin: Replaying the Tape. Current Biology 16: R53–R56.
Ruiz-Trillo, I., Inagaki, Y., Davis, L. A., Sperstad, S., Landfald, B. & Roger, A. J. 2004. Capsaspora owczarzaki is an independent opisthokont lineage. Current Biology 14: R946–R947.
Simpson A. G. B. & Roger, A. J. 2002. Eukaryotic Evolution: Getting to the Root of the Problem. Current Biology 12: R691–R693.
Simpson, A. G. B., Inagaki, Y. & Roger, A. J. 2006. Comprehensive Multigene Phylogenies of Excavate Protists Reveal the Evolutionary Positions of ‘‘Primitive’’ Eukaryotes. Molecular Biology and Evolution 23: 615–625. [pdf]
Smirnov, A. V., Nassonova, E. S., Berney, C., Fahrni, J., Bolivar, I. & Pawlowski, J. 2005.Molecular phylogeny and classification of the lobose amoebae. Protist 156: 129–142.
Stechmann, A & Cavalier-Smith, T. 2003. The root of the Eukaryote tree pinpointed. Current Biology 13: R665–R666.
Stechmann, A & Cavalier-Smith, T. 2002. Rooting the Eukaryote tree by using a derived gene fusion. Science 297: 89–91.
Steenkamp, E. T., Wright, J. & Baldauf, S. L. 2006. The Protistan Origins of Animals and Fungi. Molecular Biology and Evolution 23: 93–106. [pdf]
van der Giezen, M. & Tovar, J. 2005. Degenerate mitochondria. EMBO reports 6: 525–530. [pdf]
Yoon, H. S., Hackett, J. D, Pinto, G. & Bhattacharya, D. 2002. The single, ancient origin of chromist plastids. Proceedings of National Academy of Science. USA 99: 15507–15512. [pdf]