Parasiitide roll peremehe
(elukäigu) evolutsioonis
Š Peeter Hõrak. Kirjutatud 2001-2019
1. Sissejuhatus
Parasitism on eri
liikidesse kuuluvate organismide suhe, mille puhul parasiit elab ajutiselt või
alaliselt peremehe keha pinnal või sisemuses, toitub peremehe kulul ja
kahjustab teda, st. toimib patogeenselt.
Enamik praeguseks kindlaks tehtud liike on parasiidid,
kes evolutsioneeruvad reeglina kiiremini, kui nende peremehed. Seetõttu
peetakse kaasaegses evolutsioonilises ökoloogias patogeenide ja parasiitide
poolt tekitatud valikusurvet üheks olulisemaks evolutsiooniteguriks. Peremeeste
ja parasiitide koevolutsiooni üheks produktiks on immuunsüsteem, mis (eriti)
selgroogsetel loomadel on oma arengus saavutanud ülima keerukuse ja
komplekssuse. Ökoloogide poolne äratundmine, et niivõrd komplitseeritud ja
muude organismi funktsioonidega ülitugevalt integreeritud süsteem peab olema
kulukas, andis suhteliselt hiljutises minevikus tõuke uue teadussuuna –
immuunökoloogia tekkeks. Termin võeti esmakordselt kasutusele Dag Nordlingi
ning Ben Sheldoni ja Simon Verhulsti poolt 1996. aastal. Immuunökoloogia käsitleb organismi immuunfunktsiooni kui
elukäiguomaduste ja sugulise valiku signaaltunnustega integreeritud süsteemi,
mis konkureerib ühise ressursi pärast muude organismi füsioloogiliste
funktsioonidega. Seega eeldavad ökoloogid (lähtuvalt elukäigu evolutsiooni
teooriale omasest optimaalsusparadigmast) et nii isendi, populatsiooni kui ka
kõrgemate taksonite tasandil eksisteerivad lõivsuhed (trade-off)
immuunfunktsiooni ning sigimisse, enesesäilitamisse, ja signaaltunnustesse
tehtud investeeringute vahel. Selline lähenemisviis eristab ökolooge
immuunogeneetikutest, immunoloogidest ja füsioloogidest, kelle huviorbiidis on
reeglina konkreetsete immuunsüsteemi komponentide proksimaalsete
regulatsioonimehhanismide väljaselgitamine.
Et aru saada, millest allpool juttu tuleb, peame kõigepealt meelde tuletama
järgmised immunoloogia põhimõisted:
Organismi immuunsüsteem on evolutsioneerunud kaitsmaks peremeest patogeenide
vastu. Osa patogeene (kõik viirused, mõned bakterid ja algloomad) sigivad
peremehe rakkude sees; paljud bakterid ja suuremad parasiidid aga asustavad
rakuvälist v. rakkudevahelist ruumi ilma peremehe rakke nakatamata. Patogeenide
pinnavalke ja muid piisavalt suuri võõrmolekule (nt. patogeeni/parasiidi
elutegevuse produktid), mis kokkupuutel organismi kaitsesüsteemiga kutsuvad
esile immuunvastuse nimetatakse antigeenideks. Organismi reaktsiooni
antigeenidele, e. immuunvastust vahendavad valgelibled e. leukotsüüdid,
mis omakorda jagunevad lümfotsüütideks ja fagotsüütideks
(neutrofiilid/heterofiilid, eosinifiilid, basofiilid, monotsüüdid,
makrofaagid).
Fagotsüüdid, mis moodustavad
organismi esmase kaitseliini nakkuse varajases faasis, hävitavad mikroorganisme
mittespetsiifilise ja suhteliselt primitiivse fagotsütoosi teel. Seda
immuunsüsteemi haru, (mis eksisteerib kõikidel hulkraksetel loomadel)
nimetatakse sünnipäraseks v. kaasasündinud immuunsuseks (innate immunity); kuna sünnipärasel immuunsusel puudub pikaajaline
mälu, ei ole selle toime sama patogeeni hilisemal kohtamisel efektiivsem kui
esmasel kohtamisel.
Oluline on siinjuures märkida,
et mittespetsiifiline immuunkaitse ja sellega kaasnevad põletikuprotsessid on
organismile (võrreldes spetsiifilise immuunvastusega) suhteliselt kulukad kuna
fagotsütoosi käigus vabaneb organismi mitmesuguseid proteolüütilisi ensüüme
ning vabu radikaale jt reaktiivseid hapniku ning lämmastiku osakesi. Viimased
võivad omakorda kahjustada peremehe enda rakke ja kudesid; seda eriti juhul kui
vastavates kudedes napib vabaradikaaliliste ahelreaktsioonide peatamiseks
vajalikke antioksüdante.
Lümfotsüüdid hoolitsevad
patogeeni-spetsiifilise immuunvastuse eest; nad on võimelised kord juba kohatud
antigeene ära tundma, mistõttu taaskordsel kokkupuutumisel varemkohatud
antigeeniga on organism võimeline teda efektiivsemalt hävitama (omandatud
immuunsus; eksisteerib vaid selgroogsetel). Lümfotsüüdid jagunevad
B-lümfotsüütideks, mis sekreteerivad antikehi e. immuunoglobuliine peamiselt
rakuväliste patogeenide vastu (humoraalne immuunsus), ning
T-lümfotsüütideks, mis koordineerivad immuunvastust interaktsioonis
B-lümfotsüütide ja fagotsüütidega ning hävitavad peamiselt rakusiseseid
patogeene ja ka organismi enda vigaseid rakke (nt. 'vanad' rakud, vähirakud).
Sellist T-lümotsüütidel põhinevat immuunvastust nimetetakse rakuliseks
immuunsuseks. Immuunsus on seega organismi võime tõrjuda
haigusetekitajaid, nende mürke v. muid antigeensete omadustega võõraineid.
* Asjaliku käsitluse immuunsüsteemi toimimisest leiad Sulev Ingerpuu rakubioloogia
loengutest ja Tanel Tensoni artiklist Eesti
Looduses 2003 (vol 54) nr 9:
26–28.
Immuunsupressioon on immuunsüsteemi
pärssimine, mis vähendab organismi kaitsevõimet haiguste vastu. Meditsiinis
kasutatakse kunstlikku immuunsupressiooni taval. elundisiirdamise puhul, et
vältida irdumisreaktsiooni, v. autoimuunhaiguste (s.o. haiguste mis on
põhjustatud organismi immuunreaktsioonist iseenda kudede vastu) raviks. Loomulike
immunosupressoritena toimivad neerupealise koore hormoonid (stressihormoonid e.
glükokortikoidid) ja androgeenid (nt. testosteroon).
Evolutsioonilise loomaökoloogia lähenemisviisile on eriti olulised
järgmised immuunreaktsiooni aspektid:
- Immuunsüsteemi
ülesehitus ja immuunreaktsioon vajavad ressursse, mida organism saaks
kasutada mõneks muuks otsatrbeks. Seega puutume taas kokku sellise
nähtusega nagu lõivsuhe e. trade-off.
- Ülemäärane
ja kontrolli alt väljunud immuunvastus võib olla organismile ohtlik
(allergia, autoimmuunhaigused). Parasiidivastase immuunreaktsiooni poolt
organismile tekitatud kahju võib olla suurem parasiidi enda poolt
organismile tekitatud kahjust.
- Immuunsüsteem
on seotud enamuse organismi funktsioonidega, eriti aga
neuroendokriinsüsteemi poolt koordineeritava hormonaalse regulatsiooniga.
- Erinevad
immuunsüsteemi komponendid (rakuline v humoraalne) võivad üksteise
avaldumist vastastikku maha suruda.
- Seega, immuunfunktsioon ei ole ressurss
klassikalises mõistes, st erinevalt nt
energiast või rahast ei ole alati nii, et mida tugevam immuunvastus, seda
parem. See arusaamine (mis on oluline immuunfunktsiooniga seonduvate
lõivsuhete eksperimentaalseks uurimiseks) alles hakkab loomaökoloogidele
kohale jõudma.
Immuunfunktsiooni potentsiaalsest kulukusest
tuleneb immunoloogia kokkupuutepunkt evolutsioonilise ökoloogiaga, ning
eelkõige elukäiguteooriaga. Kuna meil on tegemist lõivsuhtega, saame esitada
küsimuse, milline on optimaalne ressursside jaotamise printsiip organismi
peamiste elukäiguomaduste (kasv, eluiga, järglaste arv) ja immuunfunktsiooni
vahel, mis kindlustab maksimaalse kohasuse.
Käesolevas loengus käsitleme immunoloogia lähenemisviisi rakendamist
järgmistes evolutsioonilises loomaökoloogia valdkondades:
Sigimise hind
Suguline valik
Populatsioonidünaamika (õige põgusalt)
Põhjalikumalt peatume kahel valdkonnal, nimelt imuunrfunktsiooni osasl
sigimise hinna kujunemisel ja sugulises valikus.
2. Immuunfunktsioon ja sigimise hind
Kurna suuruse evolutsioni loengus on juttu sellest, et keskne küsimus
elukäiguteooria jaoks, e. 'Major Life History Problem' on seletada,
kuidas paigutab organism oma investeeringuid sigimisse ja enesesäilitamisse
nii, et suurendada oma elu jooksul toodetud järglaste hulka. See küsimus lähtub
elukäiguteooria põhikontseptsioonist, mille kohaselt organismi käsutuses on
mingi piiratud hulk ressurssi, mida tuleb jaotada erinevate ja üksteisega
konkureerivate funktsioonide vahel (lõivsuhe). Siinjuures tuleb märkida, et kuigi
kontseptsioon lõivsuhetest ja sellest tulenev sigimise hinna printsiip on kogu
elukäiguteooria mõtteviisi aluseks, ei ole enamasti teada, kuidas see
toimib, st. kuidas ja miks intensiivne sigimispingutus suremise tõenäosust
suurendab.
Sobivaks näiteks on tüüpilised evolutsioonilise loomaökoloogia
uurimisobjektid - väikesed värvulised. Enamik täiskasvanud isendeid sureb
talvepoolaastal, kui keskkonnatingimused on ebasoodsad, st. temperatuurid on
madalad (mis tingib suuri energeetilisi kulutusi eluspüsimiseks) ning piisava
hulga toidu kättesaamine on samuti probleemiks. Sigimine omakorda toimub ajal,
kui toiduküllus looduses on suurim ning ka temperatuurid soodsad, ning
energeetilised kulutused enesesäilitamisele on seega madalad. Kuidas saab
selline lind maksta sigimise hinda? Üsna pikka aega arvati, et ei saagi! Nt.
Stearns oma 1992. a. ilmunud elukäiguteooria õpikus väidab, et nn.
tulusigijatel (income breeders; liigid, kes kulutavad sigimispingutusele
oma päevase energeetilise sissetuleku ja ei oma mingeid somaatilisi varusid,
mida nad saaksid sigimisse investeerida; nt. enamik värvulisi) ei saagi
sigimise hind kurna suuruse kujundamisel mingit rolli mängida, kuna nende
ainevahetus on niivõrd kiire, et igasuguse pingutuse energeetilised tagajärjed
kaotatakse paari päeva jooksul. Üks potentsiaalseid lahendusi sellele
paradoksile lähtubki immunoloogilise ökoloogia lähenemisviisist, mis väidab, et
lõivsuhe immuunfunktsiooni kasutamise ja sigimise vahel võimaldab sigimise
hinda maksta hilinemisega.
Sigimine järelmaksuga
Üldine mehhanism võiks olla järgmine: immuunsüsteemi funktsioneerimiseks
kasutatavat energiat kulutatakse muul otstarbel, milleks sigimispingutuse
korral on ilmselt eelkõige füüsiline koormus, mis kaasneb intensiivse
toiduotsingu ja poegade toiduga varustamisega. Füüsilise koormusega kaasneb
stressihormoonide e. glükokortikoidide (lindudel eelkõige kortikosterooni)
sekretsioon neerupealise koorest, millega omakorda kaasneb
immuunsupressioon, mis avaldub veres tsirkuleerivate lümfotsüütide arvu vähenemises.
Seetõttu avaneb parasiitidele nn. nakkuse aken v. nakkuskoridor.Nakkuskoridori
fenomen põhineb sellel, et kõik viirused ja osa baktereid ning algloomi
paljunevad peremeesrakkude sees, kus nad on peremehe immuunrakkude eest
suhteliselt hästi kaitstud. Kõige ohtlikum faas parasiidi seisukohast on see,
mil ta peab läbima rakuvälise ruumi ja on eksponeeritud peremehe immuunsüsteemi
nendele osadele, mis tegelevad rakuväliste antigeenide kahjutukstegemisega.
Seega, ka lühiajaline immuunsüsteemi allasurumine võib avada parasiitide jaoks
ohutu koridori, mille kaudu neil õnnestub rakusisesesse ‘ohutusse sadamasse’
jõuda (nt. Herpes-viirusel neuronisse). Tagajärjeks on kroonilised
haigused, mis ei ole organismile tavaolukorras ohtlikud, kuid mis võivad ohtlikuks
muutuda ekstreemsetes olukordades, kui organismi kaitsevõime on parajasti
(uuesti) alla surutud. Kroonilised haigused võivad taaspuhkeda nt. talvel nälja
ja külma tingimustes või rändega kaasneva kurnatuse tõttu ning sellisel nakkuse
taaspuhkemisel võivad olla peremehe jaoks saatuslikud tagajärjed. Sellise
skeemi põhjal on võimalik (vähemalt teoreetiliselt) seletada, kuidas ka
väikesed värvulised saavad järelmaksuga sigimise hinda maksta.
Füüsilisest koormusest tingitud immuunsupressioon on tegelikult hästituntud
nähtus, mida ei ole avastanud sugugi loomaökoloogid, vaid hoopis spordimeedikud
ning sõjaväearstid. Ka inimese puhul järgneb kurnavale füüsilisele pingutusele
immuunsupressioon, ning kestvusaladega tegelevatel tippsportlastel (nagu ka
sõjaväe eliitüksustes) on kurnatusega kaasnevate (peamiselt viirus-) nakkuste
vältimine tõsiseks probleemiks.
Kuidas immuunfunktsiooni ja muude kohasuse komponentide,
(nagu nt. sigimispingutus) vahelisi seoseid katseliselt kindlaks teha? Klassikalise ev. ökoloogia lähenemisviisi kohaselt on meil selleks kaks
võimalust, st. (1) võime eksperimentaalselt manipuleerida meid huvitavat
tunnust, ja vaadata, mis juhtub seejärel immuunfunktsiooniga. Sellele
komplementaarne lähenemisviis on loomulikult vastupidine, st. (2) me saame
manipuleerida loomade immuunfunktsiooni ja vaadata, mis juhtub seejärel meile
huvipakkuva tunnusega.
Millised on tõendid sigimispingutuse ja
immuunsupressiooni seostest. Seniajani üks paremaid näiteid
sigimispingutuse poolt põhjustatud immuunsupressioonist on C. Deerenbergi jt.
(1997) katsed sebravintide e. sebraamadiinidega (Taeniopygia guttata),
kus uuriti, kas sigimispingutus mõjutab lindude võimet tekitada antikehi uudse
antigeeni vastu (milleks kasutati lamba erütrotsüüte) (siit
link artiklisse). Leiti, et nende lindude osakaal, kes olid
üldse võimelised vastuseks võõrantigeenile antikehi tekitama, oli tõepoolest
kõige väiksem suurendatud pesakondadega vanemate hulgas. Samuti selgus, et
kontroll-grupi lindude hulgas, kes said valgulist lisatoitu, oli antikehi
tekitanud isendite protsent kõrgem kui standardse ratsiooniga toidetud lindudel
(valgulist lisatoitu saanud kontroll-kurnade vanemate hulgas oli praktiliselt
sama palju immunoreaktiivseid linde kui vähendatud kurni kasvatavate vanemate
hulgas). Ka oli immuunvastust tekitavate lindude osakaal madalam nende
amadiinide hulgas, keda sunniti toidu kättesaamiseks tööd tegeama (need linnud,
kes ei pidanud töötama tekitasid immuunvastuse 100%-liselt). Seega sõltus
amadiinide immuunvõime nii nende töökoormusest kui toitumuslikust seisundist.
Praeguseks on õnnestunud näidata, et ka vabas looduses pesitsevatel
lindudel võib sigimispingutus immuunvõimet vähendada. D. Nordling jt. (1998)
näitasid Gotlandil pesitsevatel kaelus-kärbsenäppidel, et suurendatud pesakondi
kasvatavad emased on tootsid Newcastle haiguse vaktsiiniga immuniseerimise
vastuseks vähem antikehi, kui kontroll ja vähendatud pesakondi kasvatavad
emased. J. J. Moreno jt. (1999, 2001) leidsid, et must-kärbsenäpi emalindudel
korreleerus rakulise immuunvastuse tugevus negatiivselt poegade toitmise
sagedusega ja päevase energiakuluga. Samuti oli eksperimentaalselt suurendatud
pesakondi toitvate emade immuunvastus pärsitud (võrreldes vähendatud ja
kontroll-pesakondi toitvate emastega).
Selgrootute kohta on samuti olemas näiteid töötamisega kaasneva
immunoloogilise hinna kohta: König & Schmidt-Hempel (1995) leidsid, et
kimalase (Bombus terrestris) mittetöötavatel töölistel (keda ei lastud
korjelennule) tekib tugevam immuunvastus nailonitüki implanteerimisele kui
kontrollisenditel, st. korjelendudel käivatel töölistel.
***
Eelnevast nägime, et sigimispingutuse v. töökoormuse manipuleerimisega võib
(vähemalt mõnikord) tõepoolest kaasneda immuunsuppressioon. Kas vastab tõele
ka komplementaarne tees, nimelt, et immuunfunktsiooni aktiveerimine
nõuab ressursse muude kohasuse komponentide arvelt? Üks väheseid häid
sellelaadseid näiteid immuunfunktsiooni ja sigimispingutuse seoste kohata on
Lundi Ülikooli teadlaste töö (Råberg et al. 2000), kus pesitsevate sinitihaste
immuunfunktsiooni manipuleeriti seeläbi, et kutsuti esile imuunvastus
difteeria-teetanuse vaktsiini vastu (kontroll-loomadele süstiti vastavalt
füsioloogilist lahust). Selgus, et linnud, kes pidid tekitama immuunvastust
vähendasid oma poegade toitmise sagedust kontrollidega võrreldes, millest saame
järeldada, et immuunvastuse tekitamise eest tuleb tõepoolest maksta, antud
juhul siis sigimispingutuse vähendamise hinnaga.
Samuti võime näite tuua immuunvastuse energeetilise hinna kohta – kui
laborihiirte immuunsüsteem aktiveeriti meriteolt pärineva võõrvalgu KLH
(Keyhole Limpet Hemocyanin) süstimisega, siis tõusis nende ainevahetustase
kontrollidega võrreldes 20-30% võrra (Demas et al. 1997). Seega: immuunsüsteemi
aktiveerimine võib olla mõnikord energetiliselt vägagi kulukas! Analoogilisi,
immuunsüsteemi energeetilist kulukust tõestavaid katseid on läbi viidud ka meie
õppetoolis – kasutades uurimisobjektidena vabalt elavaid rasvatihaseid (Ots et al. 2001),
vangistuses peetavaid rohevinte (Hõrak
et al. 2003) ja kapsaliblika nukke (Freitak et al. 2003).
Enamasti on immuunvastuse energeetiline hind ka tuvastatud, kuid mitte alati…
Miks see nii on, on esialgu veel segane. Üsna asjalik ülevaade nendest
probleemidest on ilmunud Am.Nat.
(2002) 160:S9-S22.
Võib-olla parim näide immuunsüsteemi aktiveerimise hinna kohta
loomaökoloogilises mudelis pärineb S.A. Hansseni jt. katsest hahkadega (Hanssen et al. 2004):
immuunvastuse indutseerimiseks süstiti hauduvaid emahahku lamba
erütrotsüütidega (SRBC) ning järgnevatel aastatel mõõdeti nende ellujäämust.
Ainult pooled süstitud lindudest tootsid SRBC-vastaseid antikehi. Ellujäämus
oli seejuures immuunvastust tekitanud lindudel oluliselt madalam (27 %), kui
lindudel, kes SRBC-vastaseid antikehi ei tootnud (72%).
3. Immuunfunktsioon ja suguline valik
Suguline valik on loodusliku valiku vorm, mis realiseerub sigimispartneri
valiku läbi. Sugulise valiku tagajärjel evolutsioneerunuks peetakse sooliselt
dimorfseid tunnuseid, mis suurendavad ühe sugupoole (üldjuhul isaste) sugulist
atraktiivsust kõrgenenud surmasaamise riski arvelt. Termin pärineb Darwinilt
(1871), kes väitis, et isaste ekstravagantsed sekundaarsed sugutunnused (ere
sulestik, kontrastne muster, keerukas laul või pulmamäng, kaunid sarved või
atraktiivne lõhn v. muud sellised tunnused, mis muudavad isased hästi
märgatavaks) on evolutsioneerunud emastepoolse sugulise valiku tagajärjel, sest
traditsioonilise loodusliku valikuga sellist pealtnäha kahjulike ja koormavate
tunnuste evolutsiooni seletada ei saa. Seega on niisuguste kulukate tunnuste
omamine isastele kasuks nimelt seetõttu, et emased eelistavad millegipärast
just selliste ekstravagantsete tunnustega isendeid. Sugulise valiku temaatika
keskne küsimus on, millist kasu saavad emased kulukate sugutunnustega
isaseid paariliseks valides.
Üks tänapäeval enim aktsepteeritud vastuseid sellele küsimusele on Zahavi
(1975) händikäpi e. kuluka signaliseerimise printsiip. See tähendab, et ekstravagantsete
tunnuste abil reklaamivad isased oma fenotüübilist (ja selle aluseks olevat
geneetilist) kvaliteeti, mis peegeldub võimes lubada endale kulukaid
investeeringuid signaalidesse. Signaaltunnuste väljaarendamine on
kulukas, mistõttu madalakvaliteedilised isendid ei suuda neid võltsida (sest
peaksid selleks kulutama enda elushoidmiseks vajalikku ressurssi). Signaaltunnuste
järgi partneri valimisel võivad emasloomad saada nii otsest kasu (nt.
paremakvaliteedilised isased on võimelised osutama enam vanemlikku hoolt, ning
ei kanna kopuleerumisel edasi ektoparasiite ning muid otsese kontakti teel
levivaid haigusi), kui ka kaudset, geneetilist kasu (kui isase kõrge
kvaliteet põhineb nn. headel geenidel, tasub oma geene just sellistega koos
järgmisesse põlvkonda lähetada). Üheks kesksemaks põhjuseks, mis võimaldab partneri
valiku läbi geneetilist kasu saada on päritav resistentsus
nakkushaigusetele: on ilmne, et kalleid investeeringuid signaaltunnustesse
on võimelised lubama vaid sellised isendid, kes tunnuse väljakujunemise ajal ei
pidanud kulutama liigset ressurssi haigustega võitlemiseks. Seega võivad
emasloomad hästi väljaarenenud signaaltunnustega isastega paaritudes saada
nakkushaiguste vastu resistentseid järglasi. Sellise mõttekäigu juures leiame
aga ühe olulise komistuskivi – nimelt, kui emased valivad kogu aeg endale
häid geene ainult äärmuslike signaaltunnustega partneritega paarudes, siis
peaksid ajapikku populatsiooni alles jääma vaid sellised geenid. Sellisel juhul
pole aga emastel ekstravagantsete paariliste valimisest mingit kasu. Samuti
pole siis ka isastel kasu kulukate signaaltunnuste omamisest! Teisisõnu,
pideva ühesuunalise valiku tõttu mingi kohasusega seotud tunnuse suhtes peaks
selle tunnuse osas geneetiline muutlikkus ammenduma (vt ka Toomase loeng geneetilisest
muutlikkusest). Kas ‘heade geenide’ valik saab siis signaaltunnuste
evolutsiooni põhjuseks olla?
3.1. Hamilton-Zuk’i hüpotees (HZH)
Lahenduse ülalkirjeldatud paradoksile pakkusid 1982. a. välja W. Hamilton ja M. Zuk. Hamilton
ja Zuk keskendasid oma tähelepanu asjaolule, et haigusresistentsust
määravate (ja seega kohasusega otseselt seotud) geenide osas saab
pärilik muutlikkus püsida juhul, kui parasiidi ja peremehe vahel toimub
lakkamatu võidurelvastumine e. evolutsiooniline võidujooks. Kuna
parasiidid paljunevad ja (seetõttu ka evolutsioneeruvad) kiiremini kui
peremehed, omavad nad selles võidujooksus peremeeste ees püsivat edumaad,
mistõttu peremeestel ei saa välja kujuneda erinevate põlvkondade lõikes püsivat
resistentsust. Peremehed võivad küll lühiajalises plaanis kohastuda mingi
konkreetses olukorras virulentsest parasiiditüvest jagusaamisele, kuid sellega
ei kaasne automaatselt resistentsust parasiidi järgnevate muteerunud
põlvkondade vastu. Evolutsioonibioloogid kasutavad sellise nähtuse
kirjeldamisel metafoorset terminit ‘Red Queen’, mis pärineb L.Carrolli
raamatust ‘Alice peeglitagusel maal', kus Alice kohtus Punase Kuningannaga, kes
koos oma õukonnaga paigaljooksu harrastas, ning seletas Alice’ile, et selleks,
et üldse ühe koha peal paigal püsida, tuleb joosta nii kiiresti kui vähegi
võimalik. Paraku on selle metafoori
tõlkimisega eesti keelde üks igavene häda – Red Queen on nimelt maakeeli
malend must lipp.
HZH väidab seega, et peremeeste ja parasiitide vahelise võidurelvastumise
tagajärjel leidub igas populatsioonis alati mingi osa isendeid, kes on
teistest parema päritava parasiidiresistentsusega, ja just selliste
isendite väärtus paarilistena on eriliselt kõrge, kuna neilt võib saada oma
järglastele antud hetkel kohasust enim mõjutavate parasiitide vastast
resistentsust määravaid geene. Suguline valik soosib seetõttu
sigimispartneritena isendeid, kes reklaamivad oma head tervist kulukate
sekundaarsete sugutunnuste maksimaalse väljaarendamisega. Selle protsessi
tagajärjeks ongi kulukate händikäp-tunnuste evolutsioon. Sellised
tunnused avalduvad nt. karvakatte v. sulestiku värvuses, samuti lindudel laulu
valjuses ja keerukuses jm displei- e demonstratsioonkäitumises.
HZH liikidevahelisel tasandil
HZH ennustab (nt lindude kohta), et eredama sulestikuga linnuliigid peaksid olema rohkem
parasiteeritud kui kahvatuma sulestikuga liigid, sest sellistel liikidel on
olnud suurem vajadus (ja võimalus) parasiidiresistentsusest signaliseerida.
Selle ennustuse testimiseks võrdlesid H & Z erinevaid Põhja-Ameerika
linnuliike vereparasiitidega nakatumise alusel ja leidsid, et tulemused
vastasidki (enam-vähem) ennustatutele. Seda tulemust on hiljem erinevatel
põhjustel kritiseeritud ning üritatud ka muudes süsteemides testida, kuid
tulemused on üldjuhul jäänud vastuoluliseks.
HZH liigi ja populatsiooni tasandil
Liigi ja eriti populatsioonisisesel tasandil on HZH ennustused risti
vastupidised liikidevahelisel tasandil kehtivale ennustusele, sest pideva
parasiitide poolse valikusurve tõttu peaksid ühe populatsiooni sees haigete
isendite signaaltunnused olema nõrgemini välja arenenud, kui tervete isendite
omad. Vähemalt 6 tööd lindudel on näidanud, et olukorras, kus emased
eelistavad ekstravagantsete signaaltunnustega isaseid, esinevad tõepoolest
negatiivsed seosed sekundaarsete sugutunnuste ja nakkushaiguste vahel. A.P
Mølleri ja kolleegide (1990) katsed suitsupääsukestega näitasid, et emased
eelistavad sigimispartnerina pikemate sabadega isaseid, et parasiidid mõjutavad
isase saba pikkust, ning et isaste resistentsus parasiitlestade vastu sisaldas
ka geneetilist komponenti (lühisabaliste isade poegadel oli palju parasiite ka
siis, kui nad kasvatati üles pikemasabaliste isaste pesas ning vastupidi).
Nimetatud töö ja A. Roulini jt. katse loorkakkudega (Roulin et al. 2001) on
praegu ka pea ainsateks seniavaldatud selgeteks tõenditeks signaaltunnustega
seotud parasiidiresistentsuse päritavuse kohta looduslikus populatsioonis
(parasiidiresistentsuse päritavus on kogu hüpoteesi kehtimiseks vajalik ja
keskne eeldus). Laborikatsetes erinevate putukaliikidega on
immuunfunktsiooni komponentide päritavust demonstreeritud vähemalt viies töös;
küllalt palju tõendeid immuun funktsiooni erinevate komponentide päritavuse
kohta on saadud ka koduloomade (eriti kanade) aretuskatsetes.
Lisaks HZH toetavatele töödele on avaldatud ka vähemalt 6
artiklit, mille tulemused ei ole hüpoteesiga kooskõlas. Siinkohal tuleb mainida
seda, et negatiivseid tulemusi on tõenäoliselt saadud rohkemgi, kuid kuna
selliseid on palju raskem teadusajakirjades avaldada, kui positiivseid
tulemusi, siis me ei pruugi olla nendest lihtsalt teadlikud (nn. publication
bias).
HZH teema lõpetuseks näide sellest, kuidas immuunfunktsiooni
signaliseerivatel tunnustel põhineva paarilise valiku teadvustamine võib
otseselt aidata lahendada ka praktilises loomakasvatuses ettetulevaid
probleeme. Vääriskalu (siiad, lõhelised jt.) paljundatakse tavaliselt kunstliku
viljastamise teel, kusjuures nii munad kui sperma võetakse juhuslikelt kaladelt
(kes ei saanud ise oma paarilist valida). Claus Wedekind jt. (2000) näitasid,
et kui siigade mune viljastati intensiivselt ornameteeritud isaste spermaga,
oli järlaste tõenäosus Pseudomonas fluorescens'i epideemia üle elada 10
% suurem, kui siis, kui viljastamiseks kasutati juhusliku isase spermat.
3.2. Folstad-Karteri immuunokompetentsus-händikäpi
hüpotees
HZH ühe arendusena võib vaadelda I. Folstad'i ja A. Karter'i (1992) immuunokompetentsus-
händikäpi hüpoteesi, mis väidab, et sugulise valiku ja
signaaltunnuste vahelist seost mõjutab
testosteroon. Testosteroon on isassuguhormoon, mis mõjutab
positiivselt sekundaarsete sugutunnuste ja muskulatuuri arengut,
agressiivsust ja paarumiskäitumist, kuid mõjutab sageli
negatiivselt immuunvõimet, üsna mitmete mehhanismide kaudu, mille
kirjeldamine ei ole selle loengu ülesanne. (Nt. on teada, et mõningate
näriliste puhul järgneb isaste kastreerimisele nende immuunvõime paranemine;
kui neile kastreeritud isastele süstida testosterooni, järgneb sellele
immuunsuse alanemine kastratsioonieelsele tasemele. Samuti väidavad mõned
autorid, et isaste üldise kõrgema suremuse põhjuseks (emastega võrreldes) ongi just
testosterooni toime. Ühelt poolt põhjustab testosteroon meeste agressiivset ja
displeikäitumist (nt USA-s ja vist juba ka meil on autokindlustus 20-25
aastastele meestele kallim kui samavanustele naistele; samuti on kõnekas
ingliskeelne slängiväljend "He's got no balls" argliku isiku
kohta). Teiselt poolt kannatavad mehed testosterooni immunosupressiivse
toime tõttu.
Vastavalt F-K hüpoteesile põhjustab testosteroon lõivsuhte signaaltunnuste
ja immuunkaitse vahel, soodustades ühest küljest paarumiskonkurentsis
vajaminevate tunnuste arenemist (mille tulemusena suureneb isendi kohasus
sugulise valiku läbi), teisest küljest vähendab testosteroon isendi kohasust
ellujäämusvaliku läbi, kuna ta suurendab nakkushaigustesse haigestumise riski.
Seetõttu võivad üksnes kõrge (geneetilise) resistentsusega isendid endale
üheaegselt lubada kõrget testosterooni taset ja kulukate signaaltunnuste
väljaarendamist ja/või omamist. Selline mehhanism saaks töötada seeläbi, et
resistentsusgeene omavad isendid saavad nakkuse elimineerimiseks kasutada
suhteliselt odavat spetsiifilist immuunvastust, kuna mitteresistentsed isendid
peavad selleks kasutama energeetiliselt ja immuunpatoloogiliselt kulukat
mittespetsiifilist (fagotsütoosil rajanevat) immmuunvastust. Niiviisi võib testosteroon
signaliseerimise maksustamise kaudu kindlustada signaliseerimissüsteemi aususe.
Oluline on testosterooni puhul seegi, et signaaltunnuste ja tervise vahel
esineb negatiivne tagasiside: lisaks testosteroonitaseme tõusuga kaasnevale
immuunkaitse vähenemisele, võib organismis vallandunud nakkuse tagajärjel
omakorda testosterooni tase alaneda, mistõttu nakatunud isend ei saa
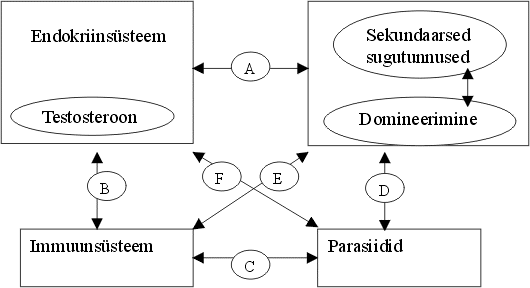
signaaltunnuseid välja arendada (Joonis 1.).
Joonis 1. Testosteroon surub alla
immuunsüsteemi, kuid stimuleerib sekundaarsete sugutunnuste avaldumist (rajad A
ja B). Parasiidid omakorda pärsivad testosterooni taseme mahasurumise kaudu
sekundaarsete sugutunnuste avaldumist (rajad C, D ja E). Testosteroonist sõltuvate
sekundaarsete sugutunnuste areng korreleerub seetõttu nakkusresistentsusega
(rada F). (Folstad & Karter 1992).
Folstad ja Karter toonitavad, et kuigi nemad kasutasid oma mudelis
testosterooni, võib selleks olla mis tahes tagasiside-mehhanismidega
reguleeritav biokeemiline aine, mis on seotud sekundaarsete sugutunnuste
arenguga ja mõjutab immuunsüsteemi funktsioneerimist. Vaatamata sellele, et on
leitud suhteliselt palju tõendeid testosterooni immuunsupressiivsest toimest
(ning nakkusega kaasnevast testosteroonitaseme langusest), ning et testosteroon
tõepoolest mõjutab sageli signaaltunnuste avaldumist, pole tänaseks avaldatud
ühtegi piisavalt elegantset tööd, mis igakülgselt tõestaks testosterooni
võtmerolli signaliseerimissüsteemi aususe kindlustamisel sugulises valikus.
Üldiselt on hüpoteesi toetavaid tulemusi saadud peamiselt imetajatel; lindude
osas on tulemused sageli vastuolulised. Üheks põhjuseks on kindlasti
ülemääraselt lihtsustatud lähenemine immuunfunktsiooni mõõtmisele – kuna
erinevad immuunsüsteemi komponendid võivad üksteise ekspressiooni vastastikku
alla suruda, võib teinekord nt rakulise immuunsuse suppresseerimise põhjuseks
olla hoopiski tugev humoraalne immuunvastus. Samuti tundub, et oluline on
testosterooni koosmõju immuunomodulatoorsete stressihormoonidega (Rantala
et al. 2012).
Suhteliselt hoolega uuritakse
testosterooni rolli sugulises valikus inimesel.
Maskuliinsemate nägudega meeste testosteroonitase on kõrgem (Roney et al. 2006)
ja sageli peavad naised maskuliinsemate nägude ning kõrgema
testosteroonitasemega mehi atraktiivemateks (Rantala
et al. 2012), kuid on leitud ka vastupidist. Vähemalt ühel juhul on näidatud, et atraktiivsemate nägudega
ja kõrgema testosteroonitasemega mehed olid tõepoolest võimelised tekitama
tugevamat immuunvastust uudsele antigeenile (atraktiivsed mehed tootsid
B-hepatiidi vaktsiini vastaseid antikehi rohkem, kui vähem-atraktiivsed mehed; Rantala
et al. 2012). Samuti on leitud, et kõrgendatud hügieenivajadusega naistele,
st sellistele, kelles igasugused potentsiaalselt nakatumisega seostuvad
olukorrad maksimaalset jälkustunnet (pathogen
disgust) tekitavad, meeldivad mehed kellel on maskuliinsemad näod,
hääletämbrid ja kehaehitus (Jones
et al. 2013).
Et asi oleks veelgi segasem, siis olgu siinkohal öeldud,
et kuigi testosteroon ja selle derivaadid on tuntud eelkõige isas-suguhormoonidena,
on neil oluline roll täita ka emasorganismis. Anaboolse steroidina stimuleerib
testosteroon lihasmassi juurdekasvu; meenutagem siinkohal kasvõi Kristina Šmiguni
nn. dopinguskandaali
2002. a.. OM-l. Naistel on testosterooni allikaks neerupealise koor ja
munasarjad, ning selle sekretsioon suureneb, nii nagu meestelgi,
kuramaažikäitumise (flirtimise) ning seksuaalse erutuse korral. Samuti on maternaalsel testosteroonil oluline
roll linnumuna ja linnupoegade arengus. Võib ennustada, et Folstad-Karteri
hüpotees kuulub lähiajal tõsisele revideerimisele. See iseenesest ei tähenda,
et eelpoolloetu tuleks otsekohe unustda – tegemist on siiski seniaegse sugulise
valiku teooria jaoks ühe väga keskse hüpoteesiga.
Miks testosteroon on immuunsupressiivne?
Siiani esitatud seisukohad nii sigimise hinna, kui
immuunokompetentsus-händikäpi kohta eeldasid, et nii stress kui ka testosteroon
põhjustavad immuunsupressiooni. Kuna evolutsioonibiolooge huvitavad nähtuste
põhjused, siis peaksime küsima, kas sellisel immuunsupressioonil võib
olla ka adaptiivne selgitus.
Hillgarth jt. (1997) ning Folstad & Skarstein (1997) püstitasid
hüpoteesi, mille kohaselt on testosteroonil immunosupressiivne toime selleks,
et kaitsta haploidseid spermatosoide, mida keha immuunsüsteem tõlgendab kui
võõraid antigeene (kuna nad formeeruvad oluliselt hiljem pärast immuunsüsteemi
väljaarenemist). Vaatamata spermide osalisele kaitsmisele hemato-testikulaarse
barjääri poolt, võib siiski osa lümfotsüüte sattuda seemnetorukestesse.
Sellisel juhul on vaja spermide vastaste antikehade tootmine alla suruda,
mistõttu leiabki aset sigimisaegne testosteroonitaseme tõus ning sellega
kaasnev immuunsupressioon.
Vastavalt spermide kaitse hüpoteesile võivad päritud haigusresistentsusega
isased lubada endale spermatogeneesi ajal suuremat immuunsupressiooni, kuna nad
peavad samaaegselt investeerima vähem ressurssi parasiitide vastu võitlemisele.
Seega on resistentse isase jaoks immuunsupressioon odavam, kui mitteresistentse
isase jaoks. Sellisel juhul peaksid emased, kes valivad endale paariliseks
hästi 'mehelikud' isased (mehelikkus avaldub kõrge testosterooni läbi nii
käitumises kui ka sekundaarsetes sugutunnustes), omandama nii häid
resistentsusgeene oma järglaste jaoks kui ka kvaliteetset ning suure
viljastamispotentsiaaliga spermat.
Üheks parimaks tõendiks spermide kaitse hüpoteesi paikapidavuse kohta võib
pidada efektiivset meeste viljatuse ravi immuunosupresiivsete
kortkosteroid-preparaatidega. Siinkohal on jällegi tegemist nähtusega, mis on
meedikutele olnud teada juba ammu, kuid mis on loomaökoloogide fookusesse jõudnud
alles hiljaaegu (Skau &
Folstad 2005).
3.3. MHC geenid sugulise valiku märklauana
Päritav resistentsus enamiku nakkushaiguste vastu on määratud geenidega, mis paiknevad suures koesobivuskompleksis (Major Histocompatibility Complex e. MHC). MHC geenid kodeerivad MHC molekule, mis paiknevad makrofaagide pinnal ja presenteerivad antigeene neid hävitavatele T-lümfotsüütidele. Tähelepanuväärne on siinjuures asjaolu, et MHC on kõige polümorfsem geenikomplekt enamikus seniajani uuritud loomapopulatsioonides. Polümorfsus tähendab seda, et potentsiaalselt leidub populatsioonis väga palju erinevaid alleele, mis määravad resistentsust erinevate parasiitide antigeenide vastu. Immuunvastust määravad alleelid on enamasti kodominantsed, mis tähendab, et igal juhul on kasulik omada järglasi, kes on immuungeenide osas võimalikult heterosügootsed. Sellest lähtuvalt on kasulik valida endale sigimispartner, kes on endast MHC lookuse võimalikult paljude alleelide osas erinev ja/või kõrge MHC heterosügootsusega (mehhanismidest ja sellest mispoolest partneri valik sarnasuse ja heterosügootsuse põhjal erinevad tuleb juttu loengus; lugeda võib selle kohta siit: Winternitz et al. 2017). Ja niimoodi tõepoolest paistavad talitavat vähemalt hiired ja inimesed, kasutades koesobivuskompleksi geenide äratundmiseks lõhnaretseptoreid. C. Wedekind ja S. Füri (1997) [siit võid vaadata lõbusat videoklippi])viisid läbi katse, kus lassid naisüliõpilastel võrrelda meesüliõpilaste lõhnade meeldivust (selleks tuli neil nuusutada meeste alussärke mida viimased olid öösiti kandnud). Selgus, et naistele meeldisid kõige rohkem nende meeste lõhnad, kes omasid vastavate naiste koesobivuskompleksi alleelide suhtes kõige rohkem erinevamaid alleele. Veelgi enam, naised väitsid, et just need lõhnad meenutasid neile kõige enam nende praeguste v. endiste elukaaslaste lõhnu. Eelnevast võime teha järelduse, et paarilise valik inimesel on seotud koesobivuskompleksi alleelide polümorfismiga. Huvitav on siinjuures see, et neil naistel kes võtsid katse ajal rasedusvastaseid pille, oli eelistus vastupidine, st. neile meeldisid kõige rohkem endaga sarnaste MHC geenidega meeste lõhnad. Miks see nii on, ei tea; põhjuse üle võib vaid spekuleerida (nt. et pillid simuleerivad organismis rasedusseisundit ja raseduse korral on soovitav viibida parem sugulaste seltskonnas (hõimuvaliku printsiibi tõttu) kui tegelda paarilise valikuga). Täiendavaks tõendiks MHC geenide seotuses paarilise valikuga on selline nähtus nagu postkopulatoorne valik, st. spontaanseid aborte esineb nii inimestel kui närilistel rohkem sellisel juhul, kui partnerid omavad sarnast MHC haplotüüpi. Seda tulemust kinnitavad ka in vitro kunstliku viljastamise katsed. (väga head ülevaadet probleemist vt. Penn & Potts (1999).
4. Adaptiivsed seletused immuunsupressioonile
Nii nagu testosterooni korral võime ka stressi puhul küsida, kas
stressisündroomiga kaasnevast immuunsupressioonist võib organismile mingit kasu
olla. Et järgnevast selgitusest aru saada, peame meenutama sellist probleemi
nagu immuunreaktsiooni poolt peremeesorganismile tekitatud kahjustused.
Üheks näiteks selle kohta, millist kahju võib immuunsüsteem peremehele
tekitada, on autoimmuunsus ja autoimmuunhaigused. Autoimmuunhaiguste
olemus seisneb selles, et immuunsüsteem ei suuda mingil põhjusel ära tunda
peremehe enda kudesid või peremehele ohutuid ning süütuid välisantigeene ning
seetõttu hakkab tootma antikehi peremehe rakkude vastu. Sellise protsessi
tagajärjed võivad olla äärmiselt tõsised. Autoimmuunhaiguste näideteks on
sellised tõved nagu reumatoidartriit, multiskleroos (sclerosis
multiplex), lupus erythematosus,
esimest tüüpi diabeet, primaarne maksatsirroos, krooniline hepatiit. Lisaks
autoimmuunhaigustele kahjustab kaitsesüsteem peremehe kudesid ka erinevate
allergiate jm. hüpersensitiivsusreaktsioonide korral. Käesoleva loengu
kontekstis on autoimmuunhaiguste juures oluline tähele panna seda, et neid
ravitakse immuunosupressantidega, milleks mõnikord kasutatakse kortikosteroide
(mille immuunsupressiivsest toimest oli eelnevalt juttu). Emaste üldiselt
madala testosteroonitaseme tõttu (millest omakorda on tingitud nende madalam
stressihormoonide tase) on ootuspärane, et autoimmuunhaigused kujutavad endast
naiste jaoks suuremat probleemi, kui meestele.
Kui testosterooni puhul märkisin, et just immuunsupressiivsete androgeenide
mõju peetakse oluliseks põhjuseks, miks meeste eluiga on lühem kui naistel,
siis siinsest tabelist on näha, et vaatamata oma pikemale elueale pole ka
naised kergesti pääsenud. Ja seda justnimelt sama probleemi teise aspekti
tõttu, nimelt, et kui meeste mureks oli ülemääraselt nõrk immuunfunktsioon,
siis naiste probleemiks on see, et nende immuunfunktsioon on ülemääraselt tugev
mistõttu 75% autoimmuunhaigusi tababki justnimelt naisi.
Immuunpatoloogiatel peatusime äsja nii pikalt seetõttu, et sellise nähtuse
teadvustamine aitab meil aru saada lõivsuhtest parasiidiresistentsuse ja
immuunvastuse poolt organismile tekitatud kahju vahel, e. adaptiivsest
seletusest, miks stressiga kaasnev immuunsupressioon võib olla kasulik.
1.
Parasiidivastasel immuunreaktsioonil
on oma kasu (mis seisneb efektiivses parasiidivastases võituses) ja hind
(mida tuleb maksta immuunsüsteemi aktiveerumisega kaasneva võimaliku
koekahjustuste arvelt). Seetõttu tekib lõivsuhe haigusele vastupanu
(resistentsuse) ja immuunpatoloogia vahel - suurema resistentsusega kaasneb
suurem immuunpatoloogia ning väiksema immuunpatoloogia hinnaks on
väheefektiivne parasiidivastane võitlus.
2.
Optimaalne lahendus sellele
lõivsuhtele, e. optimaalne immuunvastus on selline olukord, kus resitentsusest
saadava kasu ja immuunpatoloogiast tingitud hinna suhe on
maksimaalne.
3.
See optimum peaks olema erinev
heas ja halvas konditsioonis isenditele, sest halvas konditsioonis, e. stressis
organismide jaoks on immuunpatoloogiast tingitud kahjustused ohtlikumad, e.
teisisõnu, immuunvastuse hind on nende jaoks kõrgem kui heas seisundis
e. stressivabade organismide jaoks.
Selline selgitus on arvatavasti meedikutele juba
ammu teada, kuid loomaökoloogiasse toodi see alles 1998. aastal kahe sõltumatu
uurimisgrupi poolt. Huvitavaks teeb selle hüpoteesi asjaolu, et ta võimaldab
selgitada mõningaid üsna hämmastavaid tulemusi, mis on näidanud, et
immuunvastuse energeetiline kulukus võib olla mõnikord üliväike.
Näide. E. Svensson koos
kolleegidega (1998) Lundi Ülikoolist sooritasid eksperimendi, kus suurendati
sinitihaste energiakulu külma-stressi abil (eksperimentaalgruppi hoiti öösiti
-15o juures ja päeval +4oC juures, ning kontrollgruppi
hoiti +20o juures toatemperatuuril). Mõlemaid gruppe immuniseeriti
võõraste antigeenidega (teetanuse ja difteeria vaktsiin) ning vastavalt mõõdeti
mõlemas grupis mõlema vaktsiini vastu tekitatud antikehade kontsentratsioon, e.
humoraalse immuunvastuse tugevus. Selle katse tulemus näitas tõepoolest, et
külmas hoitud linnud tekitasid vastuseks mõlemale antigeenile nõrgema
immuunvastuse. Et nüüd kindlaks teha, kas selle nähtuse põhjustas immuunvastuse
energeetiline kulukus (st. kas külmas hoitud lindudel tekkis nõrgem immuunvastus
seepärast, et neil ei olnud piisavalt energiat antikehade tootmiseks),
võrdlesid uurijad järgmiseks immuniseeritud ja mitteimmuniseeritud lindude
ainevahetuskulusid, eeldades, et vaktsineeritud grupis peaks olema
põhiainevahetus kiirem ja energiakulu suurem, kui kontrollgrupis. Need
mõõtmised näitasid, et vaktsineeritud grupi lindude energiakulu ei olnud
oluliselt suurem kontrollgrupi omast, ning et mõlema grupi põhiainevahetustase
(PAV) erines vaid mõne protsendi poolest. Selle põhjal tegid autorid
järelduse, et humoraalne immuunvastus ei ole energeetiliselt kuigi kulukas, mis
tõstatab omakorda küsimuse sellest, miks siis külmas hoitud linnud
tekitasid nõrgema immuunvastuse. Autorite poolt pakutud selgitus väitis, et
külmaga kaasneva stressi korral võib immuunsüsteemi aktiveerimine olla
orgnismile ohtlikum kui soodsamates tingimustes, kus energiakulu muudele
funktsioonidele (nt. immuunvastusest tingitud koekahjustuste likvideerimisele)
on väiksem.
Üheks otseseks põhjuseks, miks
võib olla immuunvastus eriti ohtlik just kõrge ainevahetustaseme juures on
see, et nii kõrgendatud ainevahetusega kaasneva suurendatud hapnikutarbimisega,
kui ka immuunvastusega kaasneb vabade hapniku radikaalide jt reaktiivsete osakeste teke. Reaktiivsed osakesed võivad olla ohtlikud (juhul kui organismis ei ole parajasti
piisavalt sobivaid antioksüdante nende neutraliseerimiseks), sest nad võivad
kahjustada peremehe kudesid. Seega, organismi jaoks võib olla ohtlik
samaaegselt kulutada palju energiat ning tekitada immuunvastust. Seepärast
ei pea tulemusi, kus immuunsüsteemi aktiveerimisega kaasneb sigimispingutuse
vähendamine, sugugi alati seletama immunvastuse otsese energeetilise
kulukusega. Nt. on võimalik, et linnud vähendavad immuunvastuse tekitamise ajal
poegade toitmise sagedust hoopis seetõttu, et vältida ülemäärast vabade
radikaalide produktsiooni, mis kaasneb kõrge töökoormuse tõttu kiirenenud
ainevahetusega. Paraku ei ole senini väga veenvaid näiteid sellise seletuse paikapidavusest mõnes ökoloogilises mudelis leitud.
5. Immuunsüsteemi osast populatsiooni arvukuse
regulatsioonis
Eelpoolmainitud MHC geenide polümorfsusega on võimalik seletada ka
mõningaid populatsiooni arvukust reguleerivaid protsesse. Asjaolust, et
populatsioonis esineb samade MHC lookuste osas väga paljude erinevate
parasiitide vastast resistentsust määravaid alleele, tuleneb paratamatult
olukord, kus populatsiooni arvukuse kahanemisele nakkushaiguste tagajärjel
järgneb geneetilise polümorfismi vähenemine MHC lookustes. Järgnevas,
populatsiooni kasvu faasis pärineb senisest suurem osa isendeid sama
resitentsusalleeli omavatest esivanematest, mis omakorda vähendab
populatsiooni kui terviku vastupanuvõimet uutele parasiitidele. Kui sellist
populatsiooni tabab uus epideemia, elavad selle jällegi üle eelkõige need
loomad, kes omavad alleele, mis tagavad resistentsuse uue parasiidi vastu; seetõttu
populatsioon kahaneb jällegi, ning taas väheneb polümorfsus teatud imuunvastuse
alleelide osas. Vähemalt mõned autorid (nt Lochmiller 1996) usuvad, et
koesobivuskompleksi geenide polümorfsuse vähenemine, mis kaasneb ja järgneb
populatsiooni kahanemisele, võib olla üheks loomapopulatsioonide arvukuse
tsüklilist varieeruvust põhjustavaks teguriks.
Selle väitega on kooskõlas tulemused, mis näitavad, et paljudel ohustatud liikidel nagu nt. gepardid, Aasia lõvid, lõuna
lonthülged ja Przewalski hobused, on tõepoolest
MHC alleelide mitmekesisus palju väiksem, kui mitteohustatud liikudel. Siit
lähtuvad ka praktilised soovitused nt. loodusesse taasintrodutseeritavate
liikide kohta – kui loodusesse lastavaid isendeid kasvatada väga
sanitaarsetes tingimustes ning nakkushaigusi välja ravides, siis võivad
populatsioonist kaduma minna olulised resistentsusgeenid, mille püsimist
parasiitidepoolne surve muidu soosinuks.
Loomapopulatsioonide majandamise puhul on samuti oluline märgata, et
selline arvukuse kõikumist tugevalt mõjutav tegur nagu suremus on otseselt
seotud immuunsusega. Kiskjate saagiks langevad eelkõige nakkushaigustest
nõrgestatud isendid, kes on ka nakkuste peamisteks levitajateks. Kiskjate
arvukuse vähendamine võib seetõttu nakkuste levikut looduslikes populatsioonides
soodustada, nagu on näidatud keldi rabapüü ja nematoodi Trichostrongylus tenuis süsteemis (Packer
et al. 2003). Sellised nähtused on olulised nii looduskaitsebioloogia
kui ka veterinaaria seisukohast. Nt juhul kui samad parasiidid nakatavad nii metsikuid
kui koduloomi (või võivad koduloomadele üle kanduda) võib kiskjate arvukuse
piiramine mõjuda negatiivselt nii looduslike populatsioonide geneetilisele
kvaliteedile kui ka loomakasvatusele.
Ka vastsündinute suremus sõltub ema toitumusest ja konditsioonist just
immunoloogiliste mehhanismide tõttu. Kui ema on tiinuse ja imetamise ajal
alatoitumuses v haige, siis saavad vastsündinud imetajad koos emapiimaga vähem
maternaalseid immunoglobuliine (mis peavad järglasi kaitsma seni, kuni areneb
välja nende endi immuunsüsteem) ning samuti vähem valku ja energiat oma
imuunsüsteemi ülesehitamiseks, mis muudab nad omakorda vastuvõtlikumaks
nakkushaigustele. Sama mehhanism toimib arvatavasti lindudel: kui ema on halvas
konditsioonis, siis muneb ta väikesi mune, millest tulenevalt ressurss, mille
põhjal loode v. linnupoeg hakkab üles ehitama oma imuunsüsteemi, on jällegi
piiratud. Selliseid ema konditsiooni mõjusid järglaste kohasusele nimetatakse
maternaalseteks e. emaefektideks.
Lõpetuseks
Kuigi immunoloogiline ökoloogia käivitati tänapäevases mõistes juba üle 20
a tagasi, kestab evolutsioonilises loomaökoloogias endiselt sellealaste
uurimistööde buum. ISI WOS mõõdikud näitavad alates 1998. aastast immuunoloogilise ökoloogia
alaste artiklite ja nende viitamiste pidevat tõusu, mis ei ilmuta veel platoole
jõudmise tundemärke. Mitmed mainekad ajakirjad on avaldanud
immuunökoloogia alaseid erinumbreid - Philosophical Transactions of the
Royal Society B: Biological Sciences 2009 a.
jaanuaris, Functional Ecology 2011
a. veebruaris ja Molecular Ecology
2011
a. märtsis. Mõne aja eest on ilmunud kaks suurepärast õpikut: Paul Schmid-Hempeli Evolutionary
Parasitology ja Gregory Demas ning Randy Nelsoni toimetatud Ecoimmunology.
Praegu (okt. 2019) ei ilmu naljalt ühtki käitumisökoloogia v. laiemalt loomaökoloogia (aga
ka ornitoloogia) ajakirja numbrit, kus ei ilmuks vähemalt ühte parasiitide v.
immunoloogiaga seonduvat artiklit. Sarnane suundumus valitseb ka üldökoloogia ja evolutsioonibioloogia ajakirjades. Seega on immunoloogiline ökoloogia
ikka veel valdkond, kus saab suhteliselt odavate ja lihtsate vahenditega teha
olulisi teaduslikke avastusi, mis pakuvad huvi ka laiemale teadlaste ringile.
Ilmselt pole põhjust arvata, et kõik need avastused saaksid tehtud lähima 5-10
a. jooksul, mis omakorda tähendab, et uurimis ja avaldamisvõimalused selles
valdkonnas on esialgu suhteliselt avarad. Rõõmustavalt on ka loomaökoloogide
arusaamine immuunfunktsiooniga seonduvast järjest paranemas, mistõttu
vastavateemaliste kirjutiste kvaliteet järjest paraneb. Paljudele küsimustele
pole siiski endiselt leitud ammendavaid vastuseid; mõned sellistest
probleemidest on järgnevad:
ˇ
Milles siis immuunvastuse hind ikkagi
seisneb? Teoorias on kõik justkui lihtne – esmane põletikureaktsioon ja sellega
kaasnevad mittespetsifilised fagotsütoosiprotsessid on kindlasti kulukad nii
energeetiliselt, kui immuunpatoloogiliselt. Miks aga kaasneb mõnikord
ainevahetuskiiruse suurenemine ka spetsiifilise (ja odavaks peetava) humoraalse
immuunvastusega?
ˇ
Kui tähtis ikkagi on ja kuidas
avaldub immuunvastuse immuunpatoloogiline hind? Jällegi, biomeditsiinis oleks
kõik justkui selge, kuid peaaegu puuduvad tööd, kus oleks adekvaatselt mõõdetud
nt. vabade radikaalide produktsiooni, oksüdatiivset stressi ja nendega
kaasnevaid kahjustusi loomaökoloogilises mudelsüsteemis. Nende probleemidega
tegletakse parasjagu ka meie loomaökoloogia õppetooli immuunökoloogia töörühmas.
ˇ
Miks on krooniline stress immuunsuppressiivne?
Võiks arvata et enamik loomi on oma evolutsioonilise ajaloo käigus pidevalt
pidanud kokku puutuma kroonilise stressiga, et olla piisavalt kohastunud
sellega hakkama saamiseks. Krooniline stress on isegi vastik, miks ohverdada
veel ka immuunsüsteem? Energia kokkuhoid immuunsüsteemi arvelt ei pruugi olla
piisav seletus, sest osa immuunsuppressiooniga kaasnevaid protsesse, nt.
leukotsüütide apoptoos on iseenesest energeetiliselt kulukad.
ˇ
Kuidas on nn
immuunokompetentsuse hindamiseks kasutatud parameetrid (immuunvastus uudsele
antigeenile) seotud tegeliku nakkusresistentsusega? Võiks eeldada, et loomad,
kes suudavad tekitada tugevamat immuunvastust suvalisele kunstlikule
antigeenile, saavad paremini hakkama ka tegelike parasiitidega. Praeguseks
avaldatud esimesed sellesisulised tööd on andnud paraku üsna vastuolulisi
tulemusi. Kui nii, siis kuidas me üldse saaksime hinnata loomade
immuunfunktsiooni üldist efektiivsust?
ˇ
Kas maksimaalne
nakkusresistentsus on alati optimaalne? Võib-olla soosib valik mõnikord hoopis
mõõdukat nakkustolerantsi?
Missugustes olukordades on resistentsus kasulikum kui tolerants ja vastupidi?
Kuidas tolerantsi mõõta? Uudse ja põhjaliku käsitluse nende probleemide kohta
on esitanud Råberg et al.
(2009) ja Graham
et al. (2010).
ˇ
Mis on optimaalne immuunsus ja kas see on üldse võimalik? Kui jah, siis kuidas seda tuvastada? Immuunsüsteemi erinevad
komponendid võivad olla vastastikku antagonistlikes suhetes –Th1
lümfotsüütide poolt koordineeritud põletikuline immuunvastus võib pärssida Th2
lümfotsüütide poolt koordineeritud (humoraalset) immuunvastust ja vastupidi.
(Mõned parasiitsed nematoodid nt. kasutavad seda antagonismi ära indutseerides
peremehes Th2 tüüpi immuunvastuse, mis pärsib ussidele kahjulikku Th1 vastust).
Lühike ülevaade probleemist: Ardia
et al. (2010). Kui oleme katses tuvastanud mingi immuunsüsteemi komponendi
suppresseerimise, kas ei või selle põhjuseks olla immuunsüsteemi mõne teise osa
aktiveerumine?
Kirjandust:
Õpikud:
Schmid-Hempel P, 2011. Evolutionary Parasitology. The Integrated Study of Infections, Immunology, Ecology, and Genetics. New York: Oxford University Press.
Demas GE, Nelson RJ, 2011. Ecoimmunology. New York: Oxford University Press.
Artiklid:
Ardia, D.R., Parmentier, H.K. & Vogel,
L.A. (2010) The role of constraints and limitation in driving individual
variation in immune response. Functional
Ecology: in press.
Darwin, C. 1871.
The Descent of Man, and Selection in Relation to Sex. John Murray, London.
Deerenberg, C., Apanius, V., Daan, S., & Bos, N. (1997) Reproductive
effort decrease antibody responsiveness. Proceedings of the
Royal Society of London Series B Biological Sciences 264, 1021-1029.
Demas, G.E., Chefer, V., Talan, M.I., and Nelson, R.J. 1997. Metabolic costs of mounting an antigen-stimulated immune response in adult and aged C57BL/6J mice. Am. J. Physiol. 273: 1631-1637.
Folstad, I. & Karter, A.J. (1992) Parasites, bright males, and the
immunocompetence handicap. American Naturalist 139, 603-622.
Folstad, I.
& Skarstein, F. (1997) Is male germ line control creating avenues for
female choice? Behavioral Ecology 8, 109-112.
Freitak, D.,
Ots, I., Vanatoa, A. & Hõrak, P. (2003) Immune response is energetically
costly in white cabbage butterfly pupae. Proceedings of the
Royal Society of London Series B Supplementum (Biology Letters) 270,
S220-222.
Graham, A.L., Shuker, D.M., Pollitt, L.C.,
Auld, S.K.J.R., Wilson, A.J. & Little, T.J. (2010) Fitness consequences of immune
responses: strengthening the empirical framework for ecoimmunology. Functional
Ecology, in press.
Hamilton, W. D.,
& M. Zuk. (1982) Heritable true fitness and bright birds: a role of
parasites. Science 218: 384-387.
Hanssen, S.A., D. Hasselquist, I.
Folstad and K.E. Erikstad. (2004). Costs of immunity: immune responsiveness
reduces survival in a vertebrate. Proceedings
of the Royal Society of London, Series B: Biological Sciences 271: 925-930.
Hillgarth, N., Ramenofsky, M., & Wingfield, J.C. (1997) Testosterone
and sexual selection. Behavioral Ecology 8, 108-112.
Hõrak, P., Saks, L., Ots, I., Kullisaar, T., Kollist, H. & Zilmer, M.
2003. Physiological effects of immune challenge in captive greenfinches (Carduelis
chloris). Can.
J. Zool. 81: 371-379.
Jones BC, Feinberg DR,
Watkins CD, Fincher CL, Little AC, DeBruine LM (2013) Pathogen disgust predicts
women’s preferences for masculinity in men’s voices, faces, and
bodies. Behavioral
Ecology 24:373-379.
König,C. & Schmid-Hempel,P. (1995) Foraging activity and
immunocompetence in workers of the bumble bee, Bombus terrestris L. Proceedings
of the Royal Society of London Series B 260, 225-227.
Lochmiller, R. L. (1996) Immunocompetence and animal population regulation.
Oikos 76:594-602.
Moreno J, Sanz
JJ, Arriero E, 1999. Reproductive effort and T-lymphocyte cell-mediated
immunocompetence in female Pied Flycatchers Ficedula hypoleuca. Proceedings
of the Royal Society of London Series B 266,1105-1109
Martin, L.B., Ii,
Weil, Z.M. & Nelson, R.J. (2006) Refining approaches and diversifying
directions in ecoimmunology. Integr. Comp. Biol. 46, 1030-1039.
Møller, A. P.
1990 Effects of haematophagus mite on the barn swallow (Hirundo rustica):
a test of the Hamilton and Zuk hypothesis. Evolution 44, 771-784.
Nordling, D. (1996) Immunological ecology. Indroductory Research Essay No.
64. Dept. Zool. Anim. Ecol. Sect., Uppsala University.
Ots, I., Kerimov, A.B., Ivankina, E.V., Ilyina, T.A., and Hõrak, P. 2001.
Immune challenge affects basal metabolic activity in wintering great tits. Proc. R. Soc. Lond.
B Biol. Sci. 268: 1175-1181.
Packer C, Holt RD, Hudson PJ, Lafferty KD,
Dobson AP (2003) Keeping the herds healthy and alert: implications of predator
control for infectious disease. Ecology
Letters 6:797-802.
Penn, D. & Potts, W.K. (1998) Chemical signals and parasite-mediated sexual selection. Trends in Ecology & Evolution 13, 391-396.
Penn, D.J. & Potts, W.K. (1999) The evolution of mating preferences and
Major Histocompatibility Complex genes. Am. Nat.153,
145-163.
Rantala MJ, Moore FR, Skrinda
I, Krama T, Kivleniece I, Kecko S, Krams I (2012) Evidence for the
stress-linked immunocompetence handicap hypothesis in humans. Nat
Commun 3:694
Roney JR, Hanson KN, Durante
KM, Maestripieri D (2006) Reading men's faces: women's mate attractiveness
judgments track men's testosterone and interest in infants. Proceedings of the
Royal Society B-Biological Sciences 273:2169-2175
Råberg, L., Grahn, M., Hasselquist, D., and Svensson, E. 1998. On the
adaptive significance of stress-induced immunosuppression. Proc. R. Soc.
Lond. B Biol. Sci. 265: 1637-1641.
Råberg, L.,
Nilsson, J., Ilmonen, P., Stjernman, M., and Hasselquist, D. 2000. The cost of
an immune response: vaccination reduces parental effort. Ecol. Lett. 3:
382-386.
Råberg, L., Graham, A.L. & Read, A.F.
(2009) Review. Decomposing health: tolerance and resistance to parasites in
animals. Philosophical
Transactions of the Royal Society B: Biological Sciences 364, 37-49.
Roulin A, Riols
C, Dijkstra C, Ducrest AL, 2001. Female plumage spottiness signals parasite
resistance in the barn owl (Tyto alba). Behavioral Ecology 12,103-110
Saino, N. & Møller, A.P. (1996) Sexual ornamentation and
immunocompetence in the Barn Swallow. Behavioral Ecology 7,
227-232.
Saino, N., Bolzern, A.M., & Møller, A.P. (1997) Immunocompetence,
ornamentation, and viability of male Barn Swallows (Hirundo rustica). Proc.Natl.Acad.Sci.USA.
94, 549-552.
Sheldon, B. C. & Verhulst, S. (1996) Ecological immunology: costly
parasite defences and trade-offs in evolutionary ecology. Trends Evol. Ecol.
11, 17-321.
Skau, P. A. & Folstad, I. (2005) Does immunity regulate
ejaculate quality and fertility in humans? Behavioral Ecology 16: 410-416.
Spurgin LG, Richardson DS
(2010) How pathogens drive genetic diversity: MHC, mechanisms and
misunderstandings. Proceedings
of the Royal Society B: Biological Sciences 277:979-988.
Wedekind, C. & Füri, S. (1997) Body odour preferences in men and women:
do they aim for specific combinations or simply heterozygosity? Proceedings
of the Royal Society of London Series B 264, 1471-1479.
Wedekind, C., Müller, R., and Spicher, H. 2000. Genetic benefits of mate
selection in whitefish. Proceedings of the 8th International Behavioural
Ecology Congress; Zürich 8.-12. Aug. 2000, p. 208.
Zahavi, A. 1975. Mate selection - a selection for a handicap. Journal of
theoretical Biology 53:205-214.